Studieopzet
Studieopzet CTEPH
Er zijn o.a. twee belangrijke registratiestudies met ADEMPAS gedaan in het kader van CTEPH: CHEST-2 en RACE (figuur 1).1,2
Studieopzet CHEST-21
CHEST-2 was een multicenter, open-label extensiestudie bij 237 patiënten met inoperabele CTEPH of persisterende pulmonale hypertensie na een pulmonale endarteriëctomie, die de CHEST-1-studie voltooiden.
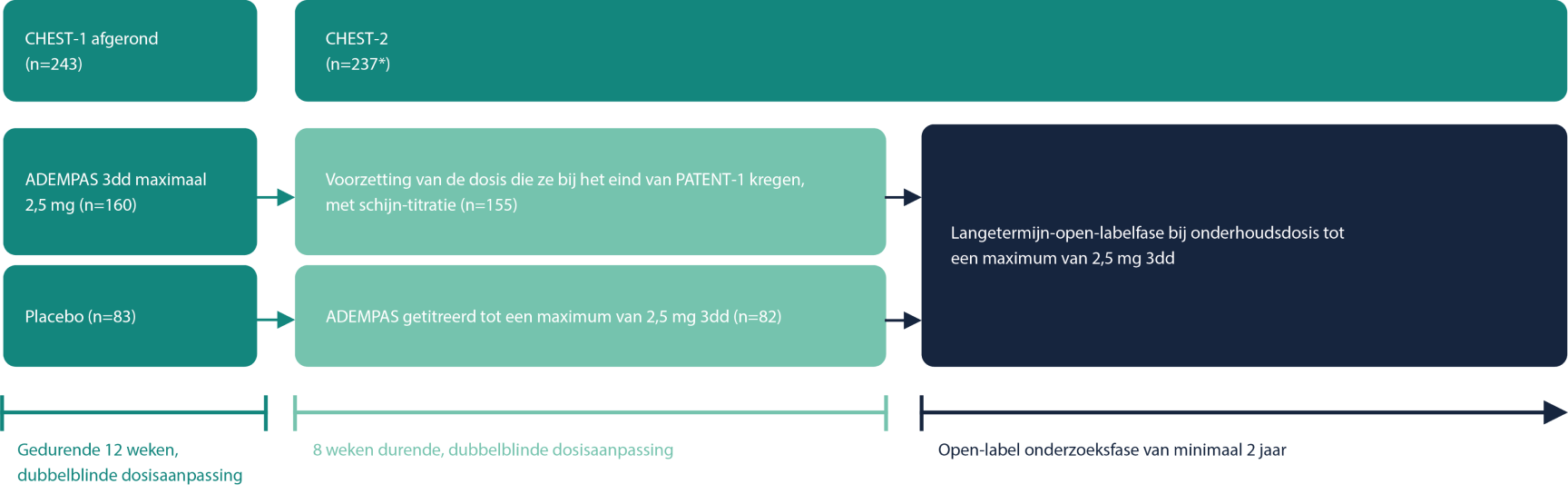
Figuur 1 – Studieopzet CHEST-21
*6 patiënten startten niet met CHEST-2
3dd = drie keer per dag
Het primaire eindpunt betrof de veiligheid en verdraagbaarheid van een lange termijn behandeling met ADEMPAS.
Veiligheidsprofiel CHEST-2-studie
Het aantal bijwerkingen was vergelijkbaar in patiënten met inoperabele CTEPH en patiënten met aanhoudende of terugkerende pulmonale hypertensie (PH) na een pulmonale endarterectomie (PEA). 6% (n = 14) van de patiënten stopten de behandeling vanwege een bijwerking.1
De meest voorkomende bijwerkingen (> 15%) waren:
- Nasofaryngitis
- Perifeer oedeem
- Duizeligheid
- Diarree
- Hoesten1
Resultaten CHEST-2-studie
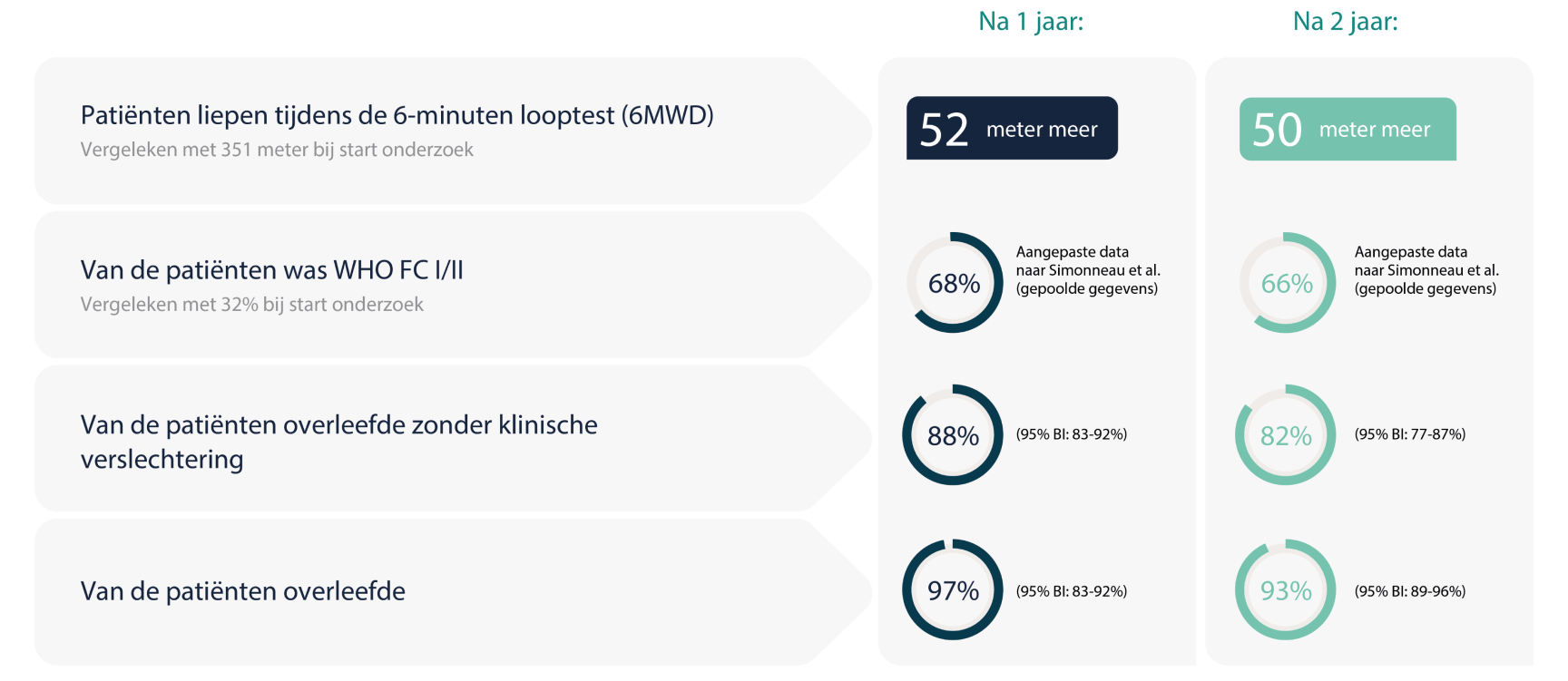
Figuur 2 – Aanhoudende resultaten na 1 en 2 jaar ADEMPAS bij CTEPH1
6MWD = 6 minuten looptest
BI = betrouwbaarheidsinterval
CTEPH = chronische trombo-embolische pulmonale hypertensie
FC = functionele klasse
WHO = Wereldgezondheidsorganisatie
RACE- en RACE extensiestudie2
| Studieopzet | Primaire eindpunten | Effectiviteit | Bijwerkingen | |
| RACE-studie | · Gerandomiseerd, open-label, parallel-groep, multicenter fase 3 · N=105 behandelnaïeve patiënten 18-80 jaar met nieuw gediagnosticeerd inoperabele CTEPH en PVR > 320 dyn·s·cm-5 · Vergelijking ADEMPAS (n=53) en BPA (n=52) | Primair eindpunt: verandering in PVR na 26 weken | Geometrisch gemiddelde (95% CI), % van uitgangswaarde met ADEMPAS was 66,7% vs. 39,9% met BPA (p<0,0001) | · Behandelgerelateerde AE’s bij 9% ADEMPAS-patiënten vs bij 42% BPA-patiënten · Meest voorkomende behandeling gerelateerde ernstige AE’s waren longschade in de BPA-groep (35%) en ernstige hypotensie met syncope in de ADEMPAS-groep (4%) |
| RACE-extensiestudie | Alle patiënten die de RACE-studie van 26 weken voltooid hadden, konden deelnemen aan een extra 26 weken durende follow-upstudie. Dit waren patiënten die ≥ WHO FC II bleven met PVR > 320 dyn·s·cm-5. Patiënten die aanvankelijk gerandomiseerd waren naar de BPA-groep kregen ADEMPAS, patiënten uit de Adempas groep kregen BPA | · Primair eindpunt: PVR in rust in week 52 · Eindpunt veiligheid: Incidentie van ongewenste voorvallen (AE) en ernstige ongewenste voorvallen (SAE) gerelateerd aan BPA | Vergelijkbare afname in PVR in week 52 bij patiënten die eerstelijns werden behandeld met ADEMPAS vs.BPA (ratio geometrisch gemiddelde 0,91, 95% BI 0,79-1,04) | Incidentie ≥ 1 SAE gerelateerd aan BPA was lager bij de patiënten die ADEMPAS in de eerste 26 weken als eerstelijnsbehandeling kregen (14%) dan bij patiënten met eerstelijns BPA (42%) |
Figuur 3 – Belangrijkste kenmerken RACE- studie2
6MWD = 6 minuten wandelafstand
AE = bijwerking
BPA = ballon pulmonalis angioplastiek
CTEPH = chronische trombo-embolische pulmonale hypertensie
NT-proBNP = N-terminaal pro-breinnatriuretisch peptide (BNP)
PEA = pulmonale endarteriëctomie
PVR = pulmonale vasculaire weerstand
SAE = ernstige bijwerking
WHO = Wereldgezondheidsorganisatie
Meer weten over Adempas?
- PH: Pulmonale hypertensie
- CTEPH: Chronische trombo-embolische pulmonale hypertensie
- WHO: World Health Organization
- FC: Functioneel classificatiesysteem
- Simonneau G, et al. Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension: data from the CHEST-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016;4(5):372-380.
- Jaïs X, et al. Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): a multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study. Lancet Resp Med. 2022;10(10):961-1971.
Naam van het geneesmiddel: Adempas® 0,5 mg, 1 mg, 1,5 mg, 2 mg en 2,5 mg filmomhulde tabletten Samenstelling: Elke filmomhulde tablet bevat: 0,5 mg/1,0 mg/1,5 mg/2,0 mg/2,5 mg riociguat. Hulpstoffen met bekend effect: Elke filmomhulde tablet bevat 37,8 mg/37,2 mg/36,8 mg/36,3 mg/35,8 mg lactose (als monohydraat). Indicaties: Chronische trombo-embolische pulmonale hypertensie (CTEPH): behandeling van volwassen patiënten met WHO functionele klasse II tot en met III met inoperabele CTEPH, persisterende of recidiverende CTEPH na chirurgische behandeling, ter verbetering van het inspanningsvermogen. Pulmonale arteriële hypertensie (PAH): Volwassenen: als monotherapie of in combinatie met endothelinereceptorantagonisten voor de behandeling van volwassen patiënten met pulmonale arteriële hypertensie (PAH) met WHO functionele klasse II tot en met III ter verbetering van het inspanningsvermogen. De werkzaamheid is aangetoond bij een PAH populatie inclusief etiologieën van idiopathische of erfelijke PAH, of met bindweefselziekte geassocieerde PAH. Kinderen:in combinatie met endothelinereceptorantagonisten geïndiceerd voor de behandeling van PAH bij pediatrische patiënten jonger dan 18 jaar met een lichaamsgewicht van ≥ 50 kg met WHO functionele klasse (FC) II tot en met III. Contra-indicaties: Gelijktijdig gebruik met PDE‑5 remmers (zoals sildenafil, tadalafil, vardenafil), ernstige leverinsufficiëntie (Child-Pugh C), overgevoeligheid voor de werkzame stof of voor (een van) de hulpstoffen, zwangerschap, gelijktijdig gebruik met nitraten of stikstofmonoxidedonoren (zoals amylnitriet), in welke vorm dan ook, inclusief partydrugs die ‘poppers’ worden genoemd, gelijktijdig gebruik met andere oplosbare guanylaatcyclasestimulatoren, start met de behandeling voor kinderen in de leeftijd van 6 tot < 12 jaar met een systolische bloeddruk < 90 mm Hg en voor patiënten ≥ 12 jaar met SBD < 95 mm Hg, patiënten met pulmonale hypertensie die gepaard gaat met idiopathische interstitiële pneumonieën (PH-IIP). Bijzondere waarschuwingen en voorzorgen bij gebruik: Bij PAH zijn studies met riociguat voornamelijk uitgevoerd bij vormen van idiopathische of erfelijke PAH en PAH geassocieerd met bindweefselziekte. Het gebruik van riociguat bij andere, niet onderzochte vormen van PAH wordt niet aanbevolen. Bij CTEPH is de voorkeursbehandeling pulmonale endarteriëctomie, omdat dit een potentieel curatieve optie is. Overeenkomstig de standaard klinische praktijk moet een deskundige beoordeling worden uitgevoerd voor operabiliteit voorafgaand aan de behandeling met riociguat. Pulmonale veno-occlusieve ziekte (PVOD): Pulmonale vasodilatoren kunnen de cardiovasculaire status van patiënten met PVOD aanzienlijk verergeren. Daarom wordt toediening van riociguat aan deze patiënten niet aanbevolen. Indien symptomen van pulmonaal oedeem optreden, dient de mogelijkheid van geassocieerde PVOD worden overwogen en dient de behandeling met riociguat worden gestaakt. Bloedingen van de luchtwegen: Patiënten met pulmonale hypertensie hebben een verhoogde kans op bloedingen van de luchtwegen, dit geldt vooral voor patiënten die anticoagulatia krijgen. Zorgvuldige bewaking van patiënten die anticoagulantia gebruiken wordt aanbevolen. Het risico op ernstige en fatale bloedingen van de luchtwegen kan tijdens behandeling met riociguat verder verhoogd zijn, vooral wanneer er risicofactoren aanwezig zijn zoals recente episodes van ernstige hemoptoë met inbegrip van bloedingen die door embolisatie van bronchiale arteriën zijn behandeld. Riociguat dient te worden vermeden bij patiënten met een voorgeschiedenis van ernstige hemoptoë en patiënten die eerder bronchiale arteriële embolisatie hebben ondergaan. In geval van bloedingen van de luchtwegen dient de voorschrijver regelmatig de voordelen en risico’s van voortzetting van behandeling te evalueren. Hypotensie: Riociguat heeft vasodilaterende eigenschappen, die kunnen leiden tot een verlaging van de bloeddruk. Voorafgaand aan het voorschrijven van riociguat dienen artsen zorgvuldig te overwegen of patiënten met bepaalde bestaande aandoeningen negatieve gevolgen kunnen ondervinden van vasodilaterende effecten (bijv. patiënten onder antihypertensiebehandeling of met hypotensie in rust, hypovolemie, ernstige obstructie van linker ventrikel uitstroom of autonome disfunctie). Riociguat mag niet worden gebruikt bij patiënten met een systolische bloeddruk lager dan 95 mm Hg. Patiënten ouder dan 65 jaar hebben een verhoogde kans op hypotensie. Daarom is voorzichtigheid geboden wanneer riociguat aan deze patiënten wordt toegediend. Nierinsufficiëntie: Er is een beperkte hoeveelheid gegevens beschikbaar van volwassen patiënten met ernstige nierinsufficiëntie (creatinineklaring < 30 ml/min) en er zijn geen gegevens beschikbaar van patiënten die worden gedialyseerd. Daarom wordt het gebruik van riociguat niet aanbevolen bij deze patiënten. Patiënten met lichte en matige nierinsufficiëntie waren geïncludeerd in de belangrijkste studies. De blootstelling aan riociguat is verhoogd bij deze patiënten. Het risico op hypotensie is bij deze patiënten hoger; daarom dient de individuele dosistitratie extra voorzichtig te worden uitgevoerd. Leverinsufficiëntie: Er is geen ervaring bij volwassen patiënten met ernstige leverinsufficiëntie (Child-Pugh C); riociguat is gecontra-indiceerd bij deze patiënten. Farmacokinetische gegevens tonen aan dat er een hogere blootstelling aan riociguat werd waargenomen bij patiënten met matige leverinsufficiëntie (Child-Pugh B). De individuele dosistitratie dient extra voorzichtig te worden uitgevoerd. Er is geen klinische ervaring met riociguat bij patiënten die vóór de start van de behandeling verhoogde lever-aminotransferasen (> 3 x ULN (Upper Limit of Normal)) of verhoogde directe bilirubine (> 2 x ULN) hebben; riociguat wordt niet aanbevolen bij deze patiënten. Zwangerschap/anticonceptie: Riociguat is gecontra-indiceerd bij zwangerschap. Daarom moeten vrouwelijke patiënten die zwanger kunnen worden een effectieve anticonceptiemethode gebruiken. Maandelijkse zwangerschapstesten worden aanbevolen. Rokers: Plasmaconcentraties van riociguat zijn lager bij rokers dan bij niet-rokers. Doseringsaanpassingen kunnen nodig zijn bij patiënten die starten of stoppen met roken tijdens de behandeling met riociguat. Gelijktijdig gebruik met andere geneesmiddelen: Gelijktijdig gebruik van riociguat met sterke CYP-remmers van meerdere routes en P-gp/breast cancer resistance protein (BCRP)-remmers, zoals azool-antimycotica (bijv. ketoconazol, itraconazol, posaconazol) of hiv-proteaseremmers (bijv. ritonavir) resulteert in een duidelijke stijging van de blootstelling aan riociguat. Weeg de voordelen en risico’s voor elke patiënt individueel af voorafgaand aan het voorschrijven van riociguat aan patiënten op stabiele doses van sterke CYP-remmers van meerdere routes en P-gp/BCRP-remmers. Overweeg dosisverlaging en controle op tekenen en symptomen van hypotensie, om het risico op hypotensie te verlagen. Bij patiënten op stabiele doses van riociguat wordt niet aanbevolen om te starten met sterke CYP-remmers van meerdere routes en P-gp/BCRP-remmers, aangezien geen doseringsaanbeveling kan worden gegeven vanwege beperkte gegevens. Alternatieve behandelingen dienen te worden overwogen. Gelijktijdig gebruik van riociguat met sterke CYP1A1-remmers, zoals de tyrosinekinaseremmer erlotinib, en sterke P‑gp/BCRP-remmers, zoals het immunosuppressivum ciclosporine A, kan de blootstelling aan riociguat verhogen. Deze geneesmiddelen dienen met voorzichtigheid te worden gebruikt. De bloeddruk dient te worden bewaakt en dosisverlaging van riociguat dient te worden overwogen. Pediatrische patiënten: De veiligheid en werkzaamheid van riociguat bij kinderen en adolescenten jonger dan 18 jaar zijn niet vastgesteld. Het gebruik van riociguat dient te worden vermeden bij kinderen en adolescenten die in de groei zijn. Informatie over hulpstoffen: Elke 0,5 mg filmomhulde tablet bevat 37,8 mg lactose. Patiënten met zeldzame erfelijke aandoeningen als galactose-intolerantie, algehele lactasedeficiëntie of glucose-galactose malabsorptie, dienen dit geneesmiddel niet te gebruiken. Bijwerkingen: De veiligheid van riociguat bij volwassenen is in fase III-onderzoeken bij 650 patiënten met CTEPH en PAH onderzocht, die ten minste een dosis riociguat kregen. Ernstige hemoptoë en longbloeding, waaronder gevallen met fatale afloop, zijn waargenomen bij patiënten met CTEPH en PAH die werden behandeld met riociguat. Bijwerkingen die in fase III-onderzoeken met riociguat bij volwassen patiënten zijn gemeld (samengevoegde gegevens van CHEST‑1 en PATENT‑1): Zeer vaak (≥ 1/10): duizeligheid, hoofdpijn, dyspepsie, diarree, misselijkheid, braken en perifeer oedeem. Vaak (≥ 1/100 tot < 1/10): gastro-enteritis, anemie (incl. betreffende laboratoriumparameters), palpitaties, hypotensie, hemoptoë, epistaxis, neusverstopping, gastritis, gastro-oesofageale refluxziekte, dysfagie, gastro-intestinale en abdominale pijn, obstipatie, opgezette buik. Soms (≥ 1/1000 tot < 1/100): pulmonale hemorragie. Pediatrische patiënten:
De veiligheid van riociguat is onderzocht bij 24 pediatrische patiënten in de leeftijd van 6 tot jonger dan 18 jaar gedurende 24 weken in een niet‑gecontroleerd open‑label onderzoek (PATENT‑CHILD), bestaande uit een individuele dosistitratiefase te beginnen met 1 mg (aangepast aan het lichaamsgewicht) gedurende 8 weken en een onderhoudsfase gedurende maximaal 16 weken, gevolgd door een optionele langetermijnextensiefase. De meest voorkomende bijwerkingen, inclusief de langetermijnextensiefase, waren hypotensie en hoofdpijn, die optraden bij respectievelijk 4/24 en 2/24 patiënten. In het algemeen zijn de veiligheidsgegevens consistent met het veiligheidsprofiel dat bij volwassenen is waargenomen.
Afleverstatus: UR. Farmacotherapeutische groep: C02KX05 Registratienummer: EU/1/13/907/001-0015. Naam en adres van de registratiehouder: Bayer AG, 51368 Leverkusen, Duitsland. Lokale vertegenwoordiger: MSD BV, Waarderweg 39, 2031 BN Haarlem, tel.: 0800 9999000, medicalinfo.nl@merck.com. Datum SPC: mei 2023. Uitgebreide informatie (SmPC) is op aanvraag verkrijgbaar.
Raadpleeg de volledige productinformatie (SPC) alvorens ADEMPAS voor te schrijven.
NL-NON-03083 | Laatste update: mei 2025